روش های ژن درمانی جدید برای بیماری های عصبی

عبور از سد خونی مغزی برای آغاز عصر ژن درمانی برای بیماری های عصبی
به گزارش سیناپرس همدان، محققان در مقاله ای با عنوان “باز شدن BBB با اولتراسوند متمرکز در پستانداران غیر انسانی و بیماران مبتلا به بیماری پارکینسون: تحویل ناقل AAV هدفمند و تصویربرداری PET” منتشر شده در Science Advances، به سرپرستی دانشگاه CEU-San Pablo در اسپانیا در مورد روشی برای عبور ایمن از سد خونی مغزی گزارش دادند.
اختلالات نورودژنراتیو مانند پارکینسون، آلزایمر و بیماری هانتینگتون هیچ گزینه درمانی یا درمانی برای کاهش سرعت پیشرفت خود ندارند. گزینههای درمانی بالقوه امیدوارکنندهای پیشنهاد شدهاند، اما به دلیل ناتوانی در عبور از سد خونی مغزی محدود شدهاند.
ژن درمانی یکی از درمان های بالقوه ای است که محققان مایلند با امید به اصلاح مکانیسم های بیماری زا، تقویت محافظت عصبی، و شروع بازسازی عصبی و ترمیم بافت آسیب دیده مغز مطالعه کنند.
ناقلهای ویروس مرتبط با آدنو (AAV) وسیلهای جذاب برای انتقال ژنها به بافتها هستند. AAV ها DNA تک رشته ای بدون پوشش کوچکی هستند که دانشمندان روی آنها کار کرده اند تا بستری برای تحویل ژن ایجاد کنند. AAVهای مهندسی شده ای وجود دارند که اکثر ژنوم های ویروسی با کاست های بیان حاوی یک پروموتر، یک بار ژنی و یک پایان دهنده جایگزین شده اند. این AAVهای تحقیقاتی نمیتوانند مانند یک ویروس وحشی تکثیر شوند، اما محموله ژنی که آنها حمل میکنند میتواند بیان شود (اغلب با یک ویروس کمکی دوم)، که بیان ژن مفید درازمدت درمانی را ارائه میکند.
مزیت ژن درمانی این است که تحویل ناقل AAV فقط گاهی مورد نیاز است زیرا مطالعات قبلی درمان هایی را نشان داده است که چندین سال یا بیشتر طول می کشد. درمانهای مولکولی دارویی نیاز به مداخلات بسیار بیشتری دارند، که معمولاً مانعی برای درمان نیست، مگر اینکه این درمان در مغز باشد.
یکی از عوامل محدود کننده در استفاده از AAVs (یا مولکول های دارویی) در مغز، سد خونی مغزی است، شبکه محکمی از سلولهای اندوتلیال محافظ، پریسیتها، آستروسیتها و میکروگلیا همگی برای جلوگیری از ورود باکتریها و مولکولهای ناخواسته پیشگیری میکنند و در عین حال اجازه میدهند اکسیژن، دیاکسید کربن و گردش آب اتفاق بیفتد.
برای عبور از مانع، AAV ها باید بسیار کوچک باقی بمانند و گزینه های بار کاست را محدود کنند. هنگامی که AAV ها از آن عبور کردند، مشکل دیگری به وجود می آید، یعنی مکان. اگر AAVها برای درمان بافتهای خاص در مکانهای خاصی از مغز مورد نیاز باشند، تنها عبور از خون-مغز ممکن است برای ایجاد اثر درمانی کافی نباشد.
در مدلهای تحقیقاتی حیوانی، عمل قرار دادن AAVها با تزریقهای درون جمجمه ای، مستقیمترین راه برای انجام آزمایش ژنتیکی درمانی، گاهی اوقات میتواند منجر به آسیب بافتی منجر به مرگ شود. به طور منطقی، این یک عامل محدود کننده هنگام بررسی آزمایشات انسانی است. همانطور که نویسندگان مطالعه اشاره می کنند، درمان بیماری های عصبی ممکن است نیاز به تحویل همزمان به چندین ناحیه مغز داشته باشد و یک رویکرد تحویل ژن ایده آل برای بیماری های مغزی باید ایمن، غیرتهاجمی و مختص منطقه باشد.
در مطالعه کنونی، محققان گزارش کردند که با استفاده از سونوگرافی کانونی با شدت پایین که توسط تصویربرداری رزونانس مغناطیسی هدایت میشود، یک سد خونی مغزی ایجاد کرده و ناقلهای AAV را به مناطق خاصی از مغز درگیر در بیماری پارکینسون میرسانند.
بیان پروتئین فلورسنت سبز نورونی به طور خاص در مناطقی با باز شدن سد خونی مغزی مشاهده شد، که تأیید می کند که روش تحویل موفق بوده است. نفوذپذیری سد خونی مغزی ظرف 24 ساعت بازیابی شد و هیچ عارضه جانبی گزارش نشد.
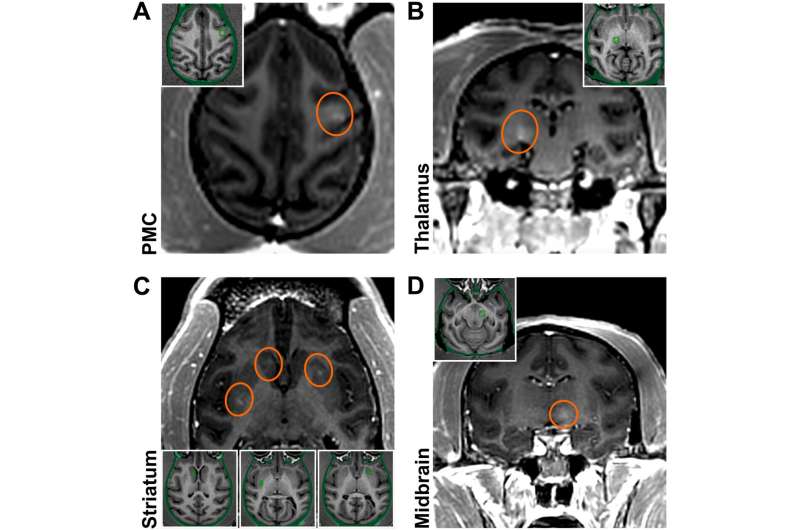
کارآزمایی اولیه بر روی میمونهای ماکاک بالغ انجام شد و پیگیری روی سه بیمار انسانی مبتلا به بیماری پارکینسون انجام شد. ماهیت کمتر تهاجمی این روش می تواند تحویل ناقل ویروسی را برای ژن درمانی تسهیل کند و مداخلات نظری برای درمان اختلالات عصبی را به واقعیت تبدیل کند.
در حالی که مطالعه کنونی بر اختلالات نورودژنراتیو متمرکز بود، بسیاری از بیماریهای دیگر از درمان محروم ماندهاند، زیرا در پشت سد خونی مغزی رخ میدهند و فراتر از دسترس درمانهای مرسوم هستند. مننژیت، سیفلیس و توکسوپلاسموز، همگی می توانند گزینه های درمانی جدیدی را با عبور ایمن از هزارتوی عروق محافظ مغز تجربه کنند.
منبع: Science Advances
مترجم: کیانوش کرمی






