به گزارش سیناپرس همدان، طی دههها سفر علمی در دانشگاه دوک، یک استراتژی آنتیبیوتیک جدید برای شکست دادن باکتریهای گرم منفی مانند سالمونلا، سودوموناس و E. coli، عامل بسیاری از عفونتهای دستگاه ادراری (UTIs) پیدا شد. این مولکول مصنوعی سریع عمل می کند و در آزمایشات حیوانی بادوام است.
این دارو با تداخل در توانایی باکتری برای ساختن لایه لیپیدی بیرونی خود عمل می کند. پی ژو، محقق ارشد، استاد بیوشیمی در دانشکده پزشکی دوک، گفت: اگر سنتز غشای خارجی باکتری را مختل کنید، باکتری ها بدون آن نمی توانند زنده بمانند. ترکیب ما بسیار خوب و بسیار قوی است.
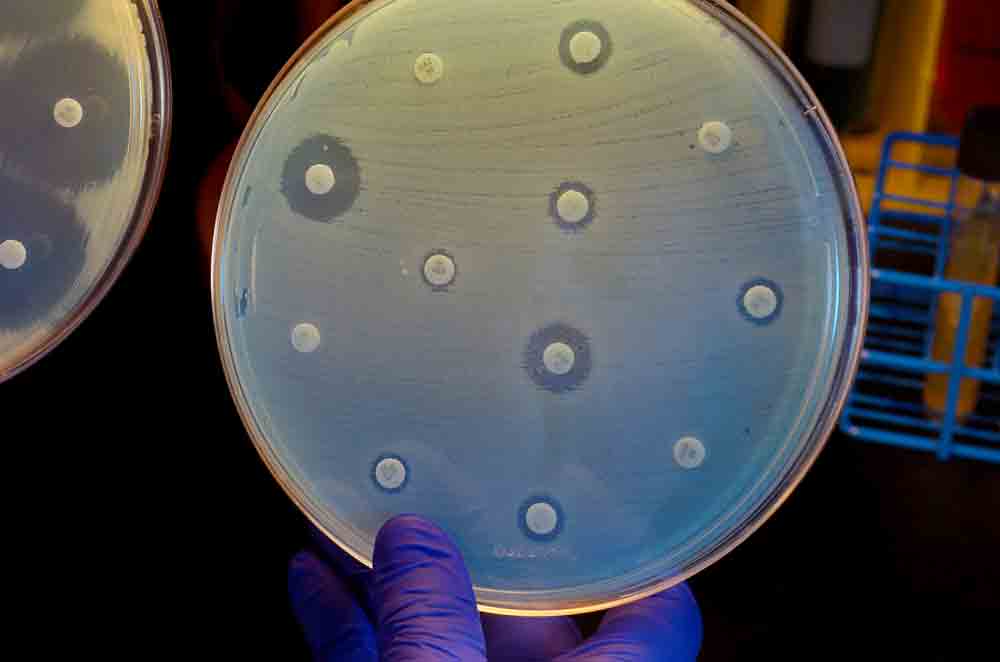
این ترکیب که LPC-233 نام دارد، مولکول کوچکی است که در توقف بیوسنتز لیپید غشای بیرونی در هر باکتری گرم منفی که روی آن آزمایش شده است، موثر است. نویسندگان همکار در دانشگاه لیل در فرانسه آن را بر روی مجموعه ای از 285 گونه باکتری، از جمله برخی از آنها که به آنتی بیوتیک های تجاری بسیار مقاوم بودند، آزمایش کردند و همه آنها را از بین رفتند.
ژو گفت: LPC-233 می تواند زنده ماندن باکتری ها را در عرض چهار ساعت 100000 برابر کاهش دهد و درواقع این عمل در نوع خود بسیار سریع است.
این ترکیب همچنین به اندازه کافی مقاوم است تا پس از مصرف خوراکی تا رسیدن به مسیر دستگاه ادراری زنده بماند، که ممکن است آن را به ابزاری حیاتی در برابر عفونت های سرسخت دستگاه ادراری (UTIs) تبدیل کند.
بر اساس مقاله ای که این یافته ها را توصیف می کند، که در Science Translational Medicine منتشر شده است، آزمایش هایی که در غلظت های بالای این ترکیب انجام شد، نرخ بسیار پایین جهش های مقاومت خود به خودی در این باکتری ها را سبب شد.
در مطالعات حیوانی، این ترکیب زمانی موفقیت آمیز بود که به صورت خوراکی و داخل وریدی یا به داخل شکم تزریق شد. در یک آزمایش، موش هایی که دوز کشنده ای از باکتری های مقاوم به چند دارو را دریافت کرده بودند، توسط این ترکیب جدید نجات یافتند.
جستجو برای این ترکیب به دلیل ویژگی و ایمنی مورد نیاز مولکول مصنوعی، چندین دهه طول کشید.
ژو گفت: کریستین راتز تمام دوران حرفه ای خود را صرف کار در این مسیر کرد. ژو گفت: دکتر راتز طرحی مفهومی برای این مسیر در دهه 1980 پیشنهاد کرد و بیش از دو دهه طول کشید تا همه عوامل دخیل را شناسایی کند.
هدف داروی جدید آنزیمی به نام LpxC است که دومین آنزیم در مسیر Raetz است و برای ساخت لیپید غشای خارجی در باکتریهای گرم منفی ضروری است.
راتز در سال 1993 پس از اینکه کارش در این مسیر در Merck & Co نتوانست یک نامزد بالینی موفق معرفی کند، به عنوان رئیس گروه بیوشیمی به دانشگاه دوک پیوست. آنتی بیوتیک Merck کار کرد، اما فقط در برابر E. coli، بنابراین از نظر تجاری قابل دوام نبود و شرکت داروسازی آن را کنار گذاشت.
ژو، که در سال 2001 به دانشگاه دوک آمد، گفت: او در واقع من را در دوک استخدام کرد تا روی این آنزیم کار کنم، در ابتدا فقط از دیدگاه زیست شناسی ساختاری با آن روبه رو شدم.
ژو و راتز ساختار آنزیم LpxC را حل کرده و جزئیات مولکولی چند بازدارنده بالقوه را آشکار کردند. ژو گفت: ما متوجه شدیم که میتوانیم ترکیب را تغییر دهیم تا آن را بهتر کنیم. از آن زمان، ژو با همکار خود، پروفسور شیمی دوک، اریک تون، برای تولید مهارکنندههای قویتر LpxC کار کرده است.
اولین آزمایش انسانی مهارکننده های LpxC به دلیل سمیت قلبی عروقی شکست خورده بود. تمرکز کار بعدی گروه دوک، اجتناب از اثرات قلبی عروقی و در عین حال حفظ قدرت ترکیب بود.
آنها روی بیش از 200 نسخه مختلف از مهارکننده آنزیم کار کردند و همیشه به دنبال ایمنی بهتر و قدرت بیشتر بودند. ترکیبات دیگر به درجات مختلف کار می کردند، اما ترکیب شماره 233 بهترین ترکیب بود.
LPC-233 بر روی یک نقطه اتصال بر روی آنزیم LpxC قرار می گیرد و از انجام کار آن جلوگیری می کند. ژو گفت: این به روشی معقول برای مهار تشکیل لیپید مناسب است. مثل این که ما سیستم را مختل کنیم.
ژو گفت که این ترکیب با افزایش دوام خود، با یک فرآیند دو مرحله ای قابل توجه کار می کند. پس از اتصال اولیه به LpxC، کمپلکس آنزیم-بازدارنده تا حدودی شکل خود را تغییر میدهد تا به یک کمپلکس حتی پایدارتر تبدیل شود.
طول عمر اتصال بازدارنده در این مجموعه پایدارتر از طول عمر باکتری است. او گفت: ما فکر می کنیم که این تغییر به پایداری کمک می کند، زیرا اثر نیمه دائمی روی آنزیم دارد. ژو گفت: حتی پس از متابولیزه شدن داروی تجویز شده توسط بدن، آنزیم همچنان به دلیل فرآیند تجزیه بسیار کند مهارکننده، مهار می شود.
ژو گفت: همه این مطالعات بر روی حیوانات انجام شد. در نهایت ایمنی قلبی عروقی باید در انسان آزمایش شود.
منبع: Science Translational Medicine
مترجم: کیانوش کرمی