به گزارش سیناپرس، چنین سلولهایی مانند تقریباً تمام سلولهای بدن انسان، تکههایی از تمام پروتئینهایی را که در داخل تولید میکنند، در سطح خود دارند.
اگر اینها شامل پپتیدهایی باشند که لنفوسیت T آنها را خارجی تشخیص دهد، لنفوسیت فعال شده و سلول مورد نظر را می کشد، بنابراین برای یک پاسخ قوی سلول T مهم است که قطعات پروتئینی مناسب به لنفوسیت T ارائه شوند.
تیم تحقیقاتی به رهبری سیمون ترویچ و رابرت تامپه از موسسه بیوشیمی در دانشگاه گوته فرانکفورت اکنون چگونگی انتخاب این قطعات پروتئینی یا پپتیدها توسط سلول را روشن کرده است.
ارائه پپتید به شکل پروتئین هایی که به اصطلاح مولکولهای کلاس اصلی سازگاری بافتی (MHC I) هستند، صورت میگیرد. مولکول های MHC I گروهی از پروتئین های سطحی بسیار متنوع هستند که می توانند هزاران پپتید مختلف را به هم متصل کنند. آنها در غشای سلولی لنگر انداخته و با قسمت بیرونی خود یک فضای اتصال پپتیدی تشکیل می دهند.
مانند تمام پروتئین های سطحی، مولکول های MHC I به اصطلاح مسیر ترشحی را طی می کنند: آنها در سیستم حفره سلولی (شبکه آندوپلاسمی (ER) و دستگاه گلژی) سنتز می شوند و در آنجا تا می گردند. سپس وزیکول های کوچک از سیستم حفره بیرون زده، به غشای سلولی مهاجرت کرده و با آن ترکیب می شوند.
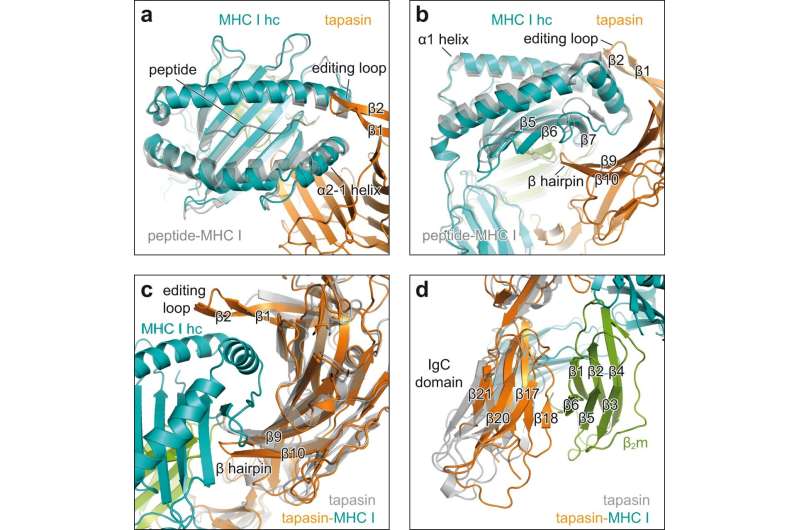
فرآیند بلوغ مولکولهای MHC I به شدت کنترل میشود: در ER، پروتئینهای معروف به "چاپرون" به آنها کمک میکنند تا تاخوردگی به خوبی انجام شود. چاپرون تاپاسین برای بارگذاری پپتید در این فرآیند ضروری است.
ترویچ، در توضیح وظیفه ی چپرون ها می گوید: زمانی که یک مولکول MHC I به یک پپتید متصل می شود، تاپاسین بررسی می کند که اتصال چقدر محکم است. اگر پیوند ناپایدار باشد، پپتید برداشته می شود و با پیوند محکم متصل می شود. با این حال، هنوز مشخص نشده است که دقیقاً تاپسین چگونه این وظیفه را انجام می دهد، به خصوص به این دلیل که فرآیند بارگیری بسیار سریع است.
بیوشیمیست ها و زیستشناسان ساختاری از دانشگاه گوته فرانکفورت اکنون برای اولین بار موفق شدهاند تعامل کوتاهمدت بین چاپرون و مولکول MHC I را با استفاده از تجزیه و تحلیل ساختار اشعه ایکس تجسم کنند.
برای انجام این کار، آنها انواعی از دو طرف یک برهمکنش را که دیگر در غشاء تعبیه نشده بودند تولید کردند، آنها را خالص کردند و آنها را به هم رساندند. روشی که به جذب کمپلکس بارگیری در عمل برای تبلور کمک کرد بدین شکل است: ابتدا، تیم تحقیقاتی مولکول MHC I را با یک پپتید با میل ترکیبی بالا بارگذاری کردند تا یک کمپلکس پایدار ایجاد شود.
یک سیگنال نوری باعث جدا شدن پپتید شد که توانایی آن را برای اتصال به مولکول MHC I کاهش داد. بلافاصله، تاپاسین وارد صحنه شد و به مولکول MHC I که فاقد پپتید بود، متصل ماند. تامپه میگوید: شکاف ناشی از عکس پپتید برای موفقیت آزمایش ما بسیار مهم بود. با کمک این بیولوژی اپتوشیمیایی، اکنون میتوانیم فرآیندهای پیچیده سلولی را یک به یک به طور سیستماتیک بازتولید کنیم.
تجزیه و تحلیل ساختار اشعه ایکس کریستال ها نشان داد که چگونه تاپاسین باعث گشاد شدن فضای اتصال پپتیدی مولکول MHC I می شود و در نتیجه استحکام پیوند پپتیدی را آزمایش می کند. برای این منظور، دو طرف یک برهمکنش یک منطقه تماس بزرگ را تشکیل می دهند. برای تثبیت، یک حلقه تاپاسین در بالای فضای اتصالی پهن شده قرار می گیرد.
تامپه میگوید: این اولین بار است که فرآیند بارگذاری را با وضوح بالا نشان میدهیم. این بیوشیمیست میگوید: این تصاویر همچنین نشان میدهند که چگونه یک چپرون میتواند با تنوع عظیم مولکولهای MHC I تعامل داشته باشد. تاپاسین دقیقاً به نواحی غیر متغیر مولکولهای MHC I متصل میشود. با این حال، ساختار جدید نه تنها درک ما را از فرآیندهای پیچیده درگیر در بارگذاری مولکولهای MHC I بهبود میبخشد. همچنین باید به انتخاب گزینه های مناسب برای ساخت واکسن کمک کند.
این تحقیق در Nature Communications منتشر شده است.
مترجم: سید سپهر ارومیهء